Кальцинированная сода, формула которой известна с давних времен, уже давно применяется во многих сферах. Многие хозяйки используют ее в быту. Ведь кальцинированная сода - это моющее средство, натуральное и безопасное.
формула и состав
Примерно лет 20 назад в каждом доме имелась упаковка этого удивительного средства. Что же собой представляет кальцинированная сода? Формула данного вещества - Na2CO3. По сути, это натриевая Это вещество представляет собой смесь мелких и крупных кристаллов белого цвета.
Он скалистый в наземных минах; по этой причине его также называют солью соли или каменной соли. Это происходит от испарения древних морских бассейнов, которые в течение миллионов лет осаждали соль в почве; области с наличием компактных водонепроницаемых пород позволили сохранить его. Химически он идентифицируется как хлорид натрия, равный морской соли, из которого он отличается своей различной консистенцией и необходимой технологией экстракции. В то время как морская соль собирается после испарения морской воды в специальном физиологическом растворе, салгемма добывается сухими минералами горной породы из слоев породы в недрах.
Стоит отметить, что порошок из окружающей среды поглощает влагу. В результате этого кальцинированная сода быстро слеживается. Поэтому рекомендуют хранить это вещество в закрытой емкости, а также в тех помещениях, где не очень высокий уровень влажности.
В промышленности для этого вещества существует ГОСТ. Сода кальцинированная выпускается согласно документу 5100 85, который был принят еще в советское время. Однако ГОСТ действует до сих пор. Согласно данной технологии, вещество делят на несколько марок: А и Б. По массовому содержанию определенных химических элементов эти составы отличаются. Это позволяет использовать каждую марку в отдельной отрасли промышленности.
В некоторых случаях альтернативный способ экстракции является предпочтительным на основе глубокой инъекции воды, что приводит к растворению сальгема: созданное соединение называется солью рассола или соляного раствора и легко извлекается на поверхность, транспортируется и работать. На географическом уровне общее производство минералов горных пород, морских и соляных солей в основном сосредоточено в Китае, США и Индии, на долю которых приходится почти 50% всего мирового объема.
В Италии годовой объем производства составляет около 3 млн. Свойства и применения С древних времен было известно, что в классическом использовании кулинарных помещений для сохранения пищи и улучшения ее вкуса. Его использование в пищевой промышленности также имеет важное значение для производства бикарбоната натрия, основным компонентом которого является. Менее широко известно, несмотря на его широкое использование, использование промышленной соли: в текстильной промышленности она используется для фиксации цветов; в строительстве, особенно в производстве плитки, кирпича и приготовления глины; также встречается в бумажной промышленности, где он используется как отбеливающий агент; в стекле, так как он полезен для регулирования процесса плавления; в фармацевтической промышленности, где особый тип хлорида натрия - названная фармацевтическая соль - является незаменимым для производства лекарств, таких как физиологические солевые растворы.
Как получают это средство?
Производство соды кальцинированной - это сложные химические процессы. Стоит отметить, что в природе в чистом виде это вещество существует, и это открытие было сделано в начале 19 века. Изначально его получали из золы, полученной в результате сожжения прибрежных растений, а также из некоторых водорослей. Конечно, человечество эволюционировало, и вместе с ним развились новые технологии. К тому же было обнаружено крупное место залегания этого вещества.
Тальк - силикат магния, основными свойствами которого являются неизменяемость, ламеллярность и мягкость. В природе тальковые породы могут быть охарактеризованы различными минералогическими ассоциациями, которые делают отдельные экстракты также очень разными; По этой причине промышленное использование часто упоминается как «тальк».
Свойства и применение Тальк используется в различных отраслях промышленности в качестве анти-упаковочного агента, в результате чего образуются гидрофобные, липофильные и некислотные кислоты и основания. Он широко используется в области резины и пластмасс: благодаря тому, что он поставляется в пластинчатых агрегатах, он выступает в качестве арматуры в самых разных областях применения, особенно в автомобильной и шинной промышленности. В литейном цехе он служит для облегчения разделения литья из формы.
На данный момент кальцинированная сода, формула которой указана выше, изготавливается несколькими способами, такими как:
- Получение из природного вещества.
- Аммиачный метод.
- Получение из нефелинового сырья.
- Карбонизация

Получение из природного сырья
Этот способ изготовления кальцинированной соды представляет собой новую промышленную отрасль. Она появилась относительно недавно, но стала основным конкурентом для тех, кто добывает это вещество аммиачным способом.
В бумажной промышленности он используется главным образом для бумаги с высоким глянцевым покрытием, увеличивая непрозрачность и улучшая качество печати. В керамике он используется в качестве литейного завода: он снижает температуру плавления эмалей, повышая его свойства остекловывания. В красках он дает однородность сушки, улучшает непрозрачный эффект, крекинг и коррозионную стойкость. Он также присутствует во многих повседневных продуктах: косметике, загрязняющих веществах в основе и других косметических продуктах или в качестве загустителя в жидких препаратах; в фармацевтике в качестве эксципиента для поддержки активных принципов; в пищевом поле, в качестве разделительного агента.
Стоит отметить, что метод был известен уже давно. Однако только в начале 20 века его смогли применить на практике. Началом для бурного развития данного направления стало открытие богатейших залежей соды (троны) в США.
Основан метод получения кальцинированной соды из природного сырья на переработке щелоков и рапы, которые образуются при растворении отложений соды. Стоит отметить, что помимо углекислого натрия в большинстве случаев удается выделить и другие компоненты, которые входят в состав исходных веществ.
Многие из его применений в сельском хозяйстве, помимо того, что они действуют как естественный инсектицид, защищают культуры от грибковых атак, помогают предотвратить потерю влаги и защищают их от воздействия ультрафиолетовых лучей, улучшая их условия роста.
Цинк - очень распространенный металл в природе, но очень редкий, как родной элемент. Он обычно содержится в минералах цинка и, в частности, в смеси, наиболее важной с точки зрения извлечения металла. В дополнение к содержанию примесей, таких как железо и кадмий, и обычно связанным с свинцовой рудой, минералы цинка имеют низкое содержание металлов, поэтому им нужна концентрация и обработка обжигом, которая превращает их в соответствующий оксид. Последующее восстановление металла может быть осуществлено с помощью тепла или электролита.
Способ Леблана
Это еще один не менее популярный способ, позволяющий получить такое вещество, как сода кальцинированная. Состав данного вещества достаточно прост, и его легко выделить из других веществ. Этот способ основан на сплавлении смеси угля и во вращающихся печах. Температура в них может достигать 1000°С. В результате этого процесса образуется содовый сплав - это сырая сода. После этого вещество подвергается выщелачиванию водой. Это требуется для извлечения из содового раствора соды.
Географически его присутствие широко распространено в разных районах планеты: основными производителями являются Китай, Австралия, Перу, США и Индия. В Европе горнодобывающая деятельность замедляется в последние десятилетия и в настоящее время сосредоточена в Ирландии и Швеции, на долю которых приходится почти 70% всего европейского производства. Италия, после ряда закрытий в последние годы, похоже, хочет начать новый этап развития.
Свойства и применение Используется в металлургии в качестве антикоррозионного средства через процесс, который берет название гальванизации и состоит в нанесении цинкового покрытия на металлические материалы, главным образом из железа и стали, для обеспечения большей устойчивости к продукту при его защите от износа, Цинк является важным компонентом в некоторых сплавах, таких как латунь, которые используются для производства многих часто используемых предметов. Кроме того, он присутствует в некоторых типах батарей, таких как классический аккумулятор, и все чаще используется в технологиях следующего поколения, связанных с накоплением энергии из возобновляемых источников.
Полученный раствор должен хорошо отстояться. Затем щелок очищают, выпаривают из него влагу, кальцинируют - прокаливают, а после измельчают в порошок. Как правило, для изготовления соды используют известняк, мел и соль.
Полезные свойства
Гост «Сода кальцинированная» 5100 85 не менялся на протяжении многих десятилетий. Благодаря разработанной технологии производства данное вещество обладает уникальными свойствами. Кальцинированная сода применяется не только в промышленности, но и в быту. Среди всех полезных качеств этого состава стоит выделить:
Преимуществом цинка для производителей аккумуляторов является, прежде всего, низкая стоимость производственного процесса, который не требует специальных обработок, таких как литий. При использовании в качестве оксида цинка увеличивается диапазон применений: также известный как белый цинк из-за его цвета, он присутствует в некоторых типах керамических плит и эмалей, поскольку он повышает прочность и блеск; может использоваться в качестве армирующего резину агента и в качестве пигмента в красках, где он не только способствует сохранению цвета, но также имеет важное фунгицидное свойство; также встречается в сельском хозяйстве как элемент питания в удобрениях и кормовых смесях.
- Способность хорошо удалять старую грязь, краску, жирные пятна.
- Хорошо очищает раковины, кафель, фарфор, эмаль и керамику.
- Справляется практически с любыми засорами в трубах.
- Смягчает воду.
- Отстирывает даже застаревшие пятна с одежды.
- Позволяет побороть садовых вредителей.
- Хорошо дезинфицирует.
Вред соды
Сода кальцинированная, техническая обладает не только достоинствами. Это вещество имеет и некоторые недостатки. Конечно, нельзя сказать, что состав способен вызвать какой-либо вред. Это будет неправильно. Скорее неправильное применение кальцинированной соды может привести к возникновению каких-либо побочных эффектов. В результате появляются негативные отзывы о средстве.
Гипохлорит натрия - натриевая соль хлорноватистой кислоты. Это зола, полученная путем сжигания водорослей, собранных на берегу. В этом золе, смешанном с водой, после того, как белье было варено. Он не знал причины, но с этой процедурой ткани были очищены. Сегодня мы знаем, что зола растений богата оксидами щелочных металлов: натрий, если это водоросли, калий, если растения земные. Они происходят от термического разрушения органических солей; в контакте с диоксидом углерода, присутствующим в воздухе, превращаются в карбонаты, основные соединения, которые в горячем растворе «вымывают» жиры, то есть отделяют их от тканей, и делают воду более способной для купания поверхностей, а затем хорошо промывают, В конце 18-го века стало ясно, что если зола была подвергнута реакции с газообразным хлором, были получены отбеливающие растворы.
Чаще всего отмечается несоблюдение мер предосторожности, а также дозировок. Раствор кальцинированной соды - это агрессивное вещество. Ошибки в дозировках, а также нарушения процесса использования могут нанести здоровью человека вред. Поэтому при работе с веществом следует помнить о правилах безопасности. К тому же не стоит забывать о том, что кальцинированная сода подходит далеко не для всех материалов.
Пепел, растворенный в горячей воде, дает каустическую соду. одно из сырьевых материалов для производства гипохлорита натрия, которое является основой для Варечина. Гипохлорит натрия всегда использовался в большинстве акведуков в Северной Европе и Северной Америке для обеспечения идеальной гигиены питьевой воды. Второе известное применение - дезинфекция вод бассейна, где известно общее название «хлор», но в равной степени широко используется в пищевой промышленности, а также в очистке сточных вод и дезинфекции в целом. для применения гипохлорита натрия дезинфицирующего средства.
Меры предосторожности
Какими свойствами обладает сода кальцинированная? Состав вещества указывает на его безопасность. Поэтому кальцинированную соду часто используют в быту. Это вещество отличается белым цветом и кристаллической структурой. Раствор соды обладает сильно выраженным щелочным эффектом. Однако само по себе вещество считается взрыво- и пожаробезопасным. Но из-за деятельности человека его относят к третьему классу.
Воды, которые будут использоваться для корма для животных и животных. Дезинфекция ран и язв. Дезинфекция столовых приборов, посуды, горшков и т.д. Белого порошкообразного вещества. Он растворяется в воде с теплоотдачей. Его водный раствор гидролизуется и реагирует с щелочью. Карбонат натрия нейтрализует высшие жирные кислоты и формы и с минеральными кислотами образует соответствующие соли. Карбонат натрия содержится в золе некоторых водорослей и многих других. другие растения.
Карбонат натрия в виде кальцинированной соды широко используется в стекольной промышленности, которая потребляет около 40% мирового производства в мыльной, химической и целлюлозно-бумажной промышленности, чтобы смягчить твердую воду, соединения натрия в составе многих, в бумажной промышленности, в дублении, в металлургии, в производстве синтетических красителей, в текстильной печати и т.д.
Сода кальцинированная, техническая - это химически активный состав. При работе с этим веществом следует соблюдать правила безопасности. Если сода попала на слизистую, то это может вызвать сильнейшее раздражение тканей. В некоторых случаях возникают даже ожоги. Если вещество попало на кожу или же в глаза, то рекомендуется промыть хорошо чистой водой пораженный участок.
Порошок карбоната натрия разрывает слизистые оболочки носа, горла, глаз и вызывает воспаление. Его водный раствор обезжиривает кожу, вызывая трещины, экзему, потерю волос и зуд. Карбонат натрия хранится в плотно закрытых контейнерах в сухом месте. Подготовка к методу: Получены два основных метода: Леблан и Солвей. Из растворителя из воды экстрагируется очень растворимая сода. Недостатками этого метода являются высокий расход топлива и тяжелое и малоэффективное оборудование, которое обслуживается медленно, поэтому этот метод уже отстает.
Не стоит забывать, что кальцинированная сода поглощает влагу. В результате ее соединения с водой образуется агрессивный раствор. Поэтому не рекомендуется использовать кальцинированную соду в помещениях, где отмечен высокий показатель влажности воздуха.
Применение в промышленности
В промышленности часто используется сода кальцинированная. Характеристика и свойства этого вещества позволяют применять его во многих отраслях. Некоторые производственные процессы очень сложно представить без участия данного компонента. К основным областям применения кальцинированной соды в промышленности стоит отнести:
Карбонат натрия, бикарбонат натрия, пищевая сода, бикарбонат соды. Карбонат натрия образует небольшие кристаллы или порошок без запаха, который способен поглощать влажность воздуха. Это происходит в дикой природе - в долларах, соленых озерах или морской воде. Он производится электролизом морской воды.
Бикарбонат натрия представляет собой белое кристаллическое вещество или мелкий порошок. Он имеет явно соленый, основной вкус, напоминающий вкус карбоната натрия. Суккокарбонат натрия представляет собой смесь карбоната натрия и бикарбоната натрия. Это происходит в виде белых кристаллов, хлопьев или в виде водорастворимого порошка.
Это вещество просто незаменимо. Кальцинированная сода применяется даже при производстве медикаментов. Его используют здесь в качестве средства для очистки, элемента для синтеза прочих химических компонентов и так далее.
Можно ли использовать в быту?
Кальцинированная сода используется многими хозяйками и в домашних условиях. Как было указано выше, это вещество представляет собой прекрасное чистящее и моющее средство. Кальцинированная сода способна очистить практически любые поверхности от жира. И все благодаря своим уникальным свойствам. К тому же это относительно дешевый аналог многих современных брендов бытовой химии. Эффективность кальцинированной соды проверена годами. Помимо этого вещество является безопасным и натуральным.
Карбонат, бикарбонат и натрий-секретарент имеют аналогичный спектр использования и в совокупности называются одним веществом в пище. Они используются для контроля кислотности и в качестве ослабляющего агента. Карбонат натрия содержится в хлебобулочных изделиях, сухих напитках и маргарине. Натрий также используется в производстве стекла, в бумажной промышленности, при производстве мыла, моющих средств и огнетушителей. Бикарбонат натрия появляется, среди прочего, в порошкообразных смесях для производства блинов, печенья и кексов и в качестве регулятора кислотности в томатных супах.
Этот состав часто используют для стирки, для удаления накипи и жира. Кальцинированная сода просто незаменима в быту. К тому же ее можно добавлять при стирки в стиральные порошок. Это позволит уберечь технику от накипи.
Борьба с вредителями
Используется кальцинированная сода в быту еще и для борьбы с садовыми вредителями. Для этого готовят простой раствор. На ведро чистой воды требуется не более 6 чайных ложечек кальцинированной соды. Готовым составом можно обработать виноградные лозы. Это средство защищает растения от серой гнили. Стоит отметить, что такой раствор подходит для обработки фруктовых растений. Вреда средство не наносит, но позволяет защитить растения от гусениц и прочих вредителей.
Помимо этого, раствор можно использовать для обработки огурцов, кабачков, дынь и капусты. Однако увлекаться кальцинированной содой не стоит. Чрезмерное ее количество вредит почве. Что, в свою очередь, может сильно повлиять на будущий урожай.
В завершение
Кальцинированная сода представляет уникальное химическое соединение, которое используется человечеством на протяжении многих лет не только во многих отраслях промышленности, но и в быту. Если соблюдать все правила безопасности, то применение этого вещества не несет вреда здоровью. Кальцинированная сода не опаснее уксуса. А ведь он тоже при неправильном использовании способен навредить нашему организму.
Вряд ли кто-то задумывался над тем, что в производстве многих вещей, которые нас окружают, применяется кальцинированная сода. К тому же изготавливает ее из природного сырья. Многие чистящие и моющие средства, стиральные порошки и прочая дорогая бытовая химия, которая продается по высоким ценам, - это раствор кальцинированной соды, который был вида изменен и разбавлен определенными добавками.
Пищевая, или питьевая сода, — широко известное в медицине, кулинарии и бытовом потреблении соединение. Это кислая соль, молекула которой образована положительно заряженными ионами натрия и водорода, анионом кислотного остатка угольной кислоты. Химическое название соды — бикарбонат или гидрокарбонат натрия. Формула соединения по системе Хилла: CHNaO 3 (брутто-формула).
Отличие кислой соли от средней
Угольная кислота образуют две группы солей — карбонаты (средние) и гидрокарбонаты (кислые). Тривиальное название карбонатов — соды — появилось еще в древности. Следует различать среднюю и кислую соли по названиям, формулам и свойствам.
Na 2 CO 3 — карбонат натрия, динатриевая соль угольной кислоты, кальцинированная стиральная сода. Служит сырьем для получения стекла, бумаги, мыла, используется как моющее средство.
NaHCO 3 — натрия гидрокарбонат. Состав подсказывает, что вещество является мононатриевой солью угольной кислоты. Это соединение отличается наличием двух разных положительных ионов — Na + и Н + . Внешне кристаллические белые вещества похожи, их трудно отличить друг от друга.
Вещество NaHCO 3 считается питьевой содой не потому, что употребляется внутрь для утоления жажды. Хотя с помощью этого вещества можно приготовить шипучий напиток. Раствор этого гидрокарбоната принимают внутрь при повышенной кислотности желудочного сока. При этом происходит нейтрализация избытка протонов Н + , которые раздражают стенки желудка, вызывают боль и жжение.
Физические свойства пищевой соды
Бикарбонат — это белые моноклинные кристаллы. В составе этого соединения присутствуют атомы натрия (Na), водорода (Н), углерода (С) и кислорода. Плотность вещества составляет 2,16 г/см3. Температура плавления — 50-60 °С. Натрия гидрокарбонат — порошок молочно-белого цвета — твердое мелкокристаллическое соединение, растворимое в воде. Питьевая сода не горит, а при нагревании свыше 70 °С разлагается на карбонат натрия, углекислый газ и воду. В производственных условиях чаще применяется гранулированный бикарбонат.

Безопасность пищевой соды для человека
Соединение не обладает запахом, его вкус — горько-соленый. Однако не рекомендуется нюхать и пробовать вещество на вкус. Вдыхание гидрокарбоната натрия может вызвать чихание и кашель. Одно из применений основано на способности пищевой соды нейтрализовать пахнущие вещества. Порошком можно обработать спортивную обувь, чтобы избавиться от неприятного запаха.
Питьевая сода (гидрокарбонат натрия) — безвредное вещество при контакте с кожей, но в твердом виде может вызвать раздражение слизистой оболочки глаз и пищевода. В низких концентрациях раствор не токсичен, его можно принимать внутрь.
Гидрокарбонат натрия: формула соединения
Брутто-формула CHNaO 3 редко встречается в уравнениях химических реакций. Дело в том, что она не отображает связь между частицами, которые образуют гидрокарбонат натрия. Формула, обычно используемая для характеристики физических и химических свойств вещества, — NaHCO 3 . Взаимное расположение атомов отражает шаро-стержневая модель молекулы:
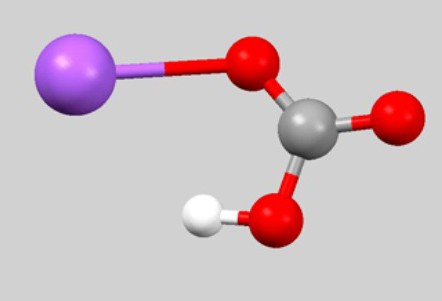
Если узнать из периодической системы значения атомных масс натрия, кислорода, углерода и водорода. то можно подсчитать молярную массу вещества гидрокарбонат натрия (формула NaHCO 3):
Ar(Na) — 23;
Ar(O) — 16;
Ar(C) — 12;
Ar(H) — 1;
М (CHNaO 3) = 84 г/моль.
Строение вещества
Гидрокарбонат натрия — ионное соединение. В состав кристаллической решетки входит катион натрия Na + , замещающий в угольной кислоте один атом водорода. Состав и заряд аниона — НСО 3 - . При растворении происходит частичная диссоциация на ионы, которые образуют гидрокарбонат натрия. Формула, отражающая структурные особенности, выглядит так:
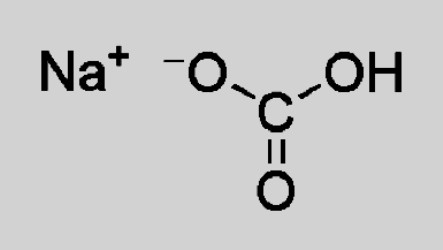
Растворимость питьевой соды в воде
В 100 г воды растворяется 7,8 г гидрокарбоната натрия. Вещество подвергается гидролизу:
NaHCO 3 = Na + + НСО 3 - ;
Н 2 О ↔ Н + + ОН - ;
При суммировании уравнений выясняется, что в растворе накапливают гидроксид-ионы (слабощелочная реакция). Жидкость окрашивает фенолфталеин в розовый цвет. Окраска универсальных индикаторов в виде бумажных полосок в растворе соды меняется с желто-оранжевой на серую или синюю.
Реакция обмена с другими солями
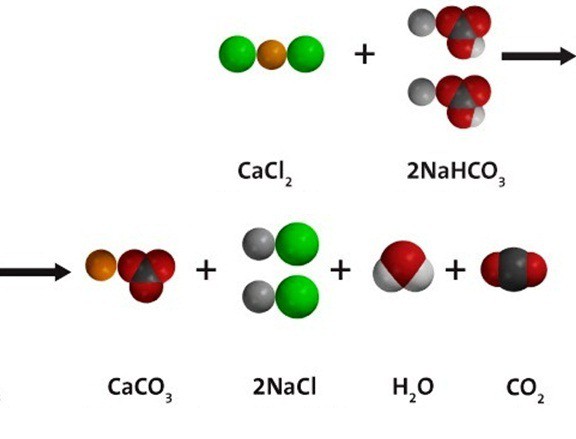
Водный раствор гидрокарбоната натрия вступает в реакции ионного обмена с другими солями при условии, что одно из вновь получившихся веществ — нерастворимое; либо образуется газ, который удаляется из сферы реакции. При взаимодействии с хлоридом кальция, как показано на схеме ниже по тексту, получается и белый осадок сарбоната кальция, и углекислый газ. В растворе остаются ионы натрия и хлора. Молекулярное уравнение реакции:
Взаимодействие питьевой соды с кислотами
Гидрокарбонат натрия взаимодействует с кислотами. Реакция ионного обмена сопровождается образованием соли и слабой угольной кислоты. В момент получения она разлагается на воду и углекислый газ (улетучивается).
Стенки желудка человека вырабатывают соляную кислоту, существующую в виде ионов
Н + и Cl - . Если принимать внутрь натрия гидрокарбонат, реакции происходят в растворе желудочного сока с участием ионов:
NaHCO 3 = Na + + НСО 3 - ;
HCl = Н + + Cl - ;
Н 2 О ↔ Н+ + ОН - ;
НСО 3 - + Н + = Н 2 О + СО 2 .
Врачи не рекомендуют постоянно использовать при повышенной кислотности желудка гидрокарбонат натрия. Инструкция к препаратам перечисляет различные побочные действия ежедневного и длительного приема питьевой соды:
- повышение давления крови;
- отрыжка, тошнота и рвота;
- тревожность, плохой сон;
- снижение аппетита;
- боли в животе.
Получение пищевой соды
В лаборатории бикарбонат натрия можно получить из кальцинированной соды. Такой же метод применялся раньше в химическом производстве. Современный промышленный способ основан на взаимодействии аммиака с углекислым газом и слабой растворимости питьевой соды в холодной воде. Через раствор хлорида натрия пропускают аммиак и диоксид углерода (углекислый газ). Образуются хлорид аммония и раствор гидрокарбоната натрия. При охлаждении растворимость питьевой соды понижается, тогда вещество легко отделяется с помощью фильтрования.
Где используется гидрокарбонат натрия? Применение пищевой соды в медицине
Многим известно, что атомы металлического натрия энергично взаимодействуют с водой, даже ее парами в воздухе. Реакция начинается активно и сопровождается выделением большого количества теплоты (горением). В отличие от атомов, ионы натрия — стабильные частицы, не наносящие вреда живому организму. Наоборот, они принимают активное участие в регуляции его функций.
Как используется неядовитое для человека и полезное во многих отношениях вещество — гидрокарбонат натрия? Применение основано на физических и химических свойствах питьевой соды. Важнейшие направления — бытовое потребление, пищевая промышленность, здравоохранение, народная медицина, получение напитков.
Среди основных свойств бикарбоната натрия — нейтрализация повышенной кислотности желудочного сока, кратковременное устранение болевого синдрома при гиперацидности желудочного сока, язвенной болезни желудка и 12-перстной кишки. Антисептическое действие раствора питьевой соды применяется при лечении боли в горле, кашля, интоксикации, морской болезни. Промывают им полости рта и носа, слизистые оболочки глаз.

Широко используются разные лекарственные формы бикарбоната натрия, например порошки, которые растворяют и применяют для инфузий. Назначают растворы для приема пациентами внутрь, промывают ожоги кислотами. Для изготовления таблеток и ректальных суппозиториев также используется гидрокарбонат натрия. Инструкция к препаратам содержит подробное описание фармакологического действия, показаний. Список противопоказаний очень короткий — индивидуальная непереносимость вещества.
Использование пищевой соды в быту
Гидрокарбонат натрия — это «скорая помощь» при изжоге и отравлении. С помощью питьевой соды в домашних условиях отбеливают зубы, уменьшают воспаление при угревой болезни, протирают кожу для удаления избытка жирного секрета. Бикарбонат натрия смягчает воду, помогает очистить загрязнения с разных поверхностей.
При ручной стирке вещей из шерстяного трикотажа можно добавить в воду питьевую соду. Это вещество освежает цвет ткани и удаляет запах пота. Нередко при глажении изделий из шелка появляются желтые подпалины от утюга. В таком случае поможет кашица из питьевой соды и воды. Вещества надо как можно быстрее смешать и нанести на пятно. Когда кашица подсохнет, ее следует почистить щеткой, а изделие прополоскать в холодной воде.
В реакции с уксусной кислотой получается ацетат натрия и бурно выделяется углекислый газ, вспенивающий всю массу: NaHCO 3 + СН 3 СООН = Na + + СН 3 СОО - + Н 2 О + СО 2 . Этот процесс идет всякий раз, когда при изготовлении шипучих напитков и кондитерских изделий питьевую соду «гасят» уксусом.

Вкус выпечки будет нежнее, если использовать не магазинный синтетический уксус, а сок лимона. На крайний случай можно заменить его смесью 1/2 ч. л. порошка лимонной кислоты и 1 ст. л. воды. Питьевая сода с кислотой добавляется в тесто в числе последних ингредиентов, чтобы можно было сразу ставить выпечку в духовку. Кроме бикарбоната натрия, иногда в качестве разрыхлителя используется гидрокарбонат аммония.




